De veranderingen in het celmembraan van Schwann cellen in de ziekte van Charcot-Marie-Tooth type 1A: een patiënt-in-een-schaal onderzoeksmethode
- TimVangansewinkel
- EstherWolfs
- JeroenBogie
- HanneJeurissen
- KarenLibberecht
- SteffieHasevoets
- SamVanherle
- MelanieLoix
Ongeveer 3 miljoen mensen wereldwijd lijdt aan de ziekte van Charcot-Marie-Tooth (CMT), een genetische zenuwziekte die we reeds bijna 150 jaar al kennen. Ondanks deze confronterende cijfers, is er tot op de dag van vandaag nog steeds geen enkele therapie die werkt. 60 tot 70% van de CMT-patiënten heeft de meest voorkomende variant, CMT type 1A (CMT1A). Ondanks vele pogingen om een eerste medicament aan deze grootste groep patiënten te kunnen voorzien, is er tot op heden nog geen enkele goedgekeurd of werkend in de mens. Het verstaan van de ziekte CMT1A, en vooral de rol van de extra kopie van het PMP22-gen hierin, is een cruciaal knelpunt op dit moment. De gevolgen van de PMP22-genduplicatie verstaan in menselijke CMT1A celmodellen is de topic van mijn thesis.
Ziekte van Charcot-Marie-Watte?
CMT1A komt ongeveer bij 1 op 4000 mensen voor. CMT1A patiënten hebben vooral bewegings- en gevoelsproblemen in de armen en benen, vaak beginnende al in de eerste tien levensjaren. De ziekte blijft aanwezig gedurende heel hun leven en kan in sommige gevallen leiden tot leven in een rolstoel. CMT1A wordt veroorzaakt door een kapotte insulerende laag rond de zenuw, vergelijkbaar met een stroomkabel. Deze laag heet myeline en wordt gemaakt door gespecialiseerde cellen, Schwann cellen genaamd. Schade in de myeline zorgt ervoor dat de zenuwen minder goed werken en leidt tot de symptomen. Hoe de Schwann cellen exact verstoord worden door de PMP22-genduplicatie, en door welke tot dusver onbekende mechanismen dit gebeurt, is nog steeds een belangrijke vraag zonder antwoord.
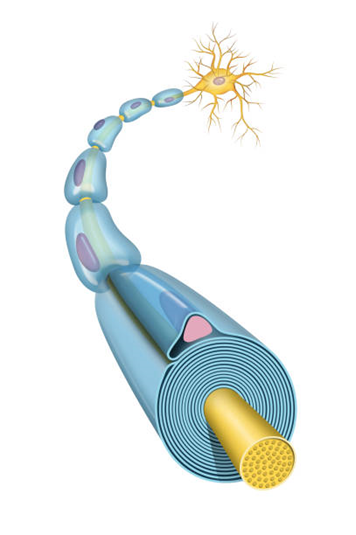
Schwann cellen en bindweefsel
In mijn thesis hebben we vooral gekeken naar het celmembraan van de Schwann cel, aangezien deze uiteindelijk ook de myelinelaag vormt. In onze onderzoeksgroep gebruiken wij voornamelijk menselijke stamcellen om een representatief ziektemodel te vormen als een soort patiënt-in-een-schaal. Stamcellen zijn cellen die nog in een heleboel andere cellen omgezet kunnen worden, een beetje zoals een cadeaukaart die je nog kan inruilen voor een cadeau naar keuze. Tot dusver is een belangrijke reden waardoor er geen medicament voor CMT1A is, de tekortkoming van de diermodellen geweest. Om erachter te komen wat er fout gaat in het celmembraan van Schwann cellen van CMT1A-patiënten, hebben we stamcellen van de huid van CMT1A patiënten gebruikt die wij in het labo dan omvormen tot Schwann cellen. Daarnaast hebben wij in het laboratorium ook tandstamcellen uit menselijke wijsheidstanden waar we het genetisch defect van CMT1A in aangebracht hebben. Om te bepalen hoezeer deze veranderd zijn, vergelijken we de zieke cellen met gezonde cellen van dezelfde patiënt. In mijn experimenten zagen we dat in de CMT1A Schwann cellen er grote veranderingen zijn in het celmembraan. Zo zien we dat integrines, een groepje moleculen die op het celmembraan zitten die zorgen voor de interactie met bindweefsel in de zenuw, sterk verschillen in hoeveelheid in CMT1A Schwann cellen ten opzichte van de gezonde cellen. Dit hebben we bepaald aan de hand van technieken zoals immunocytochemie, een microscopie techniek om de molecule te bekijken en de hoeveelheid eiwit te bepalen, en qPCR, waarmee je de hoeveelheid RNA kan bepalen die uiteindelijk omgezet wordt in de integrine eiwitten. Ook zien we dat celmigratie minder vlot verloopt in CMT1A Schwann cellen, wat ook aangeeft dat er een verminderde interactie is met het bindweefsel. Dit deden we door de cellen met een microscoop op te volgen voor meerdere dagen met foto’s om de zoveel minuten. Omdat de interactie met bindweefsel essentieel is voor het vormen van het myelinelaagje, vermoeden wij dus met deze experimenten dat de verstoring van deze integrines bijdraagt tot de kapotte myelinelaag die we zien in CMT1A-patiënten.
Vetten
Naast de integrines, moeten Schwann cellen ook genoeg en vooral ook de juiste vetten hebben om hun myelinelaag rond de zenuwen te maken. Omdat myeline voor het overgrote deel uit vetten bestaat, zorgen veranderingen hierin dus voor een onstabiele myeline laag. In een experiment waarbij we specifiek naar de vetten in het celmembraan kijken, zien we dat er een verandering is in celmembraanpolariteit. Dit geeft ons al een idee over de samenstelling aan vetten van het celmembraan en wijst op fouten in cholesterol, veranderingen in verzadigde en onverzadigde vetten, etc. Normaal gezien zijn er ook een soort vet-eilandjes aanwezig op het celmembraan, met daarin een heleboel eiwitten die hier samenwerken om efficiënt te zorgen voor de interactie van de cel met hun bindweefsel-omgeving. Wanneer we met super-resolutie microscopie kijken naar het celmembraan, zien we dat deze vet-eilandjes minder bewegen in CMT1A. Dit kan bijdragen aan een minder flexibele interactie met de bindweefselomgeving en kan zo zorgen voor minder goede vorming van myeline. Tot slot zien we bij het bekijken van vetdruppels — dienend als vetopslag voor later gebruik — in de Schwann cellen dat in CMT1A er veel minder opslag is van vetten, waardoor de cellen dus minder kunnen terugvallen op hun reserves. Dit wijst er allemaal op dat de myeline laag in CMT1A dus waarschijnlijk ook niet goed gevormd wordt door een sterk veranderd profiel aan vetsoorten en vetopslag.
Wat is de volgende stap?
Alle bevindingen in mijn thesis wijzen erop dat in CMT1A Schwann cellen een verstoorde interactie plaats vindt met het bindweefsel van de zenuw, en dat het celmembraan al verstoring heeft in zijn vetprofiel en membraanvetten zelfs voor myeline vorming. Een belangrijke volgende stap is het begrijpen hoe de aanmaak van vetten exact verstoord is, welke vetten vooral aangetast zijn en welke vetten gunstig zijn om te herstellen voor functioneel zenuwherstel. Daarnaast is het verstaan van de verandering in het integrine profiel belangrijk in verschillende stadia van de zenuwontwikkeling, zodat we deze kunnen verbeteren en zo de vorming van myeline kunnen stimuleren. De puzzel van CMT1A is dus nog niet opgelost, maar hiermee zijn er een aantal belangrijke puzzelstukken gelegd die weg maken voor vervolgonderzoek en mogelijks een toekomstige therapie voor CMT1A patiënten.









