SciMingo helpt onderzoekers het juiste evenwicht te vinden tussen complexiteit en begrijpelijkheid in wetenschapscommunicatie. Zo leren we je hoe je mensen aanspreekt zonder afbreuk te doen aan je onderzoek. Als volleerde flamingo's, meesters in evenwicht 🦩
Alcohol laat zijn sporen na
3.3 miljoen sterfgevallen per jaar wereldwijd zijn te wijten aan alcoholgebruik. Dit is 1 op 20 van alle sterfgevallen en waarschijnlijk een onderschatting van het werkelijke aantal. Tot op de dag van vandaag is het opsporen van alcoholgebruik een aantal dagen na inname nog niet optimaal. Er wordt dus nog steeds druk gezocht naar een goede techniek om dit te doen en zo de kosten verbonden aan de behandeling van alcohol-gerelateerde aandoeningen te drukken. Want zoals het spreekwoord luidt: voorkomen is altijd beter dan genezen.
Drinken kan je duur komen te staan
Wie drinkt niet eens graag een glaasje of betrapt zich er af en toe op eentje teveel te drinken? Alcohol drinken is dan ook gelinkt aan diverse sociale en culturele activiteiten en het eerste contact met alcohol gebeurt ook alsmaar vroeger. Hoewel af en toe een glaasje drinken de gezondheid niet drastisch schaadt, kan overvloedige consumptie wel aanleiding geven tot verscheidene gezondheidsproblemen en zelfs de dood.
Daarom is het voor de gezondheidszorg van financieel belang om alcoholmisbruik aan te kunnen tonen. Mensen die omwille van gezondheidsredenen, zoals nier- en leverproblemen, een drankverbod hebben, zouden kunnen gemonitord worden. In hun geval zou drinken aanleiding geven tot een verslechtering van hun toestand en dus een hogere maatschappelijke kost met zich meebrengen. Hetzelfde geldt voor mensen die omwille van alcoholproblemen opgenomen worden in instellingen. Zij hebben moeite om hun alcohol-vrij-leven vol te houden. Voornamelijk in de vrije weekends – weekends waarbij ze de instelling mogen verlaten – is de kans op terugval groot. De patiënten proberen hun consumptie te verdoezelen door de vrijdagavond al te drinken in de hoop dat de sporen van alcohol niet meer merkbaar zijn wanneer ze na hun weekend terugkeren. Dit levert misschien geen onmiddellijke fysieke schade op, maar hun verslaving verhoogt de kans hierop wel drastisch. Daarom is het opsporen en monitoren van alcoholmisbruik van groot belang om deze als het ware onnodige uitgave van financiële middelen ter behandeling van alcohol-gerelateerde gezondheidsschade te voorkomen.
Betrapt
Het opsporen van zwaar alcoholmisbruik is vandaag de dag relatief eenvoudig. Er zijn verscheidene technieken die zwaar alcoholgebruik betrouwbaar kunnen aantonen. Helaas is de monitoring van alcoholontzegging bij patiënten in behandeling voor hun alcoholverslaving nog niet optimaal.
Momenteel is een enkele inname die twee of meer dagen voor de meting plaatsvond moeilijk op te sporen. Er is een groot aandeel aan merkers – chemische stoffen in het lichaam die het bewijs zijn van inname – maar deze overbruggen een periode van maximaal anderhalve dag, hierna zijn ze verdwenen uit het lichaam. De periode waarin de aanwezigheid zichtbaar is, is ook afhankelijk van in welke lichaamsvloeistof de meting gebeurt. Zo zijn de meeste merkers langer aantoonbaar in urine dan in bloed. Haar wordt soms ook geanalyseerd, maar is onderhevig aan vele factoren en kan enkel worden gebruikt om ernstig alcoholmisbruik aan te tonen.
In de zoektocht naar betere merkers is de focus gelegd geweest op acetyltaurine (NAT) in urine. Een merker die ontstaat door de reactie in ons lichaam van de opgenomen alcohol met taurine, een stof die in ieders lichaam voorkomt en die verscheidene belangrijke lichamelijke functies heeft zoals de bescherming van celmembranen. Deze stof werd gemeten in ontdooide urinestalen van acht testpersonen. In september 2015 moesten de proefpersonen op verschillende tijdstippen na het drinken van een vooropgestelde hoeveelheid alcohol een urinestaal leveren. Deze werden ingevroren en uiteindelijk werd de concentratie ervan vergeleken met de merker die momenteel routineus gebruikt wordt om recent alcoholgebruik aan te tonen, namelijk ethylglucuronide (EtG).
Blijf op je hoede
De uiteindelijke uitkomst van het onderzoek maakt duidelijk dat de optimale merker nog steeds niet gevonden is. De nieuwe merker toont wel degelijk een relatie met alcoholinname, zelfs een beperkte inname van 0.7 promille, wat ongeveer overeenstemt met het drinken van 3 glazen bier, is aantoonbaar. Helaas is de periode waarin het aantoonbaar is maar 24u en korter dan de standaardmerker, EtG, die reeds gebruikt wordt.
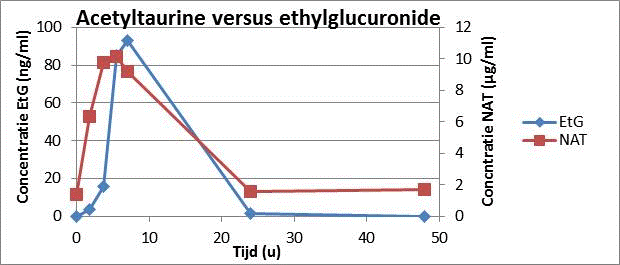
Verandering van concentratie acetyltaurine en ethylglucuronide in urine over tijd na het drinken van alcohol.
Hoewel acetyltaurine geen aanleiding geeft tot het gewenste resultaat is het onderzoek naar een goede merker voor monitoring van alcoholontzegging nog zeker niet afgerond. Er komt een tijd waarin het tijdstip van consumptie en wat je precies gedronken hebt achterhaald kan worden.. Hou dat maar in je achterhoofd wanneer iemand je vraagt om ‘nog eentje’ te drinken.
Bibliografie
1. WHO. Alcohol: Global status report on alcohol and health. World Health Organization, 2014.
2. O’Keefe JH, Bybee KA, Lavie CJ. Alcohol and Cardiovascular Health: The Razor-Sharp Double-
Edged Sword. Journal of the American College of Cardiology. 2007;50(11):1009-14.
3. Pannequin J, Delaunay N, Darido C, Maurice T, Crespy P, Frohman MA, et al.
Phosphatidylethanol accumulation promotes intestinal hyperplasia by inducing ZONAB-mediated cell
density increase in response to chronic ethanol exposure. Mol Cancer Res. 2007;5(11):1147-57.
4. Alcohol-Use Disorders: Diagnosis, Assessment and Management of Harmful Drinking and
Alcohol Dependence. Leicester UK: The British Psychological Society & The Royal College of
Psychiatrists.; 2011.
5. Jongeren en alcohol. Brussel: Hoge gezondheidsraad, 2006 6/12/2006. Report No.: HGR
8109.
6. Zeigler DW, Wang CC, Yoast RA, Dickinson BD, McCaffree MA, Robinowitz CB, et al. The
neurocognitive effects of alcohol on adolescents and college students. Prev Med. 2005;40(1):23-32.
7. WHO. Country profiles. 2014.
8. Boogaerts T, Covaci A, Kinyua J, Neels H, van Nuijs ALN. Spatial and temporal trends in
alcohol consumption in Belgian cities: A wastewater-based approach. Drug and Alcohol Dependence.
9. Casteels Y, Focant N, Nuyttens N. Statistische analyse van verkeersongevallen 2009. Brussel:
Belgisch Instituut Voor Verkeersveiligheid, 2011 D/2011/0799/105.
10. Lorant V, Nicaise P. Binge drinking at university: a social network study in Belgium. Health
promotion international. 2014;30(3):675-83.
11. Farke W, Anderson P. Binge drinking in Europe. Adicciones. 2007;19(4):333-9.
12. Devaux M, Sassi F. Alcohol consumption and harmful drinking: OECD Publishing.
13. Cederbaum AI. ALCOHOL METABOLISM. Clinics in liver disease. 2012;16(4):667-85.
14. Zakhari S. Overview: How Is Alcohol Metabolized by the Body? Alcohol Research and Health.
2006;29(4):245-54.
15. Redondo AH, Korber C, Konig S, Langin A, Al-Ahmad A, Weinmann W. Inhibition of bacterial
degradation of EtG by collection as dried urine spots (DUS). Anal Bioanal Chem. 2012;402(7):2417-24.
16. Saé Muñiz-Hernández JBV-F, José Díaz-Chávez, Rosa C López-Sánchez, José A Hernández ,
Rendón-Ramírez aA. Alcoholism: Common and Oxidative Damage Biomarkers. Journal of Clinical
Toxicology. 2014.
17. Wurst FM, Kempter C, Metzger J, Seidl S, Alt A. Ethyl glucuronide: a marker of recent alcohol
consumption with clinical and forensic implications. Alcohol. 2000;20(2):111-6.
49
18. Bergström J, Helander A, Jones AW. Ethyl glucuronide concentrations in two successive
urinary voids from drinking drivers: relationship to creatinine content and blood and urine ethanol
concentrations. Forensic Science International. 2003;133(1–2):86-94.
19. Czech E, Hartleb M. Non-oxidative metabolism of ethanol and its influence on the metabolic
pathway of serotonin and transferrin. Probl Forensic Sci. 2002;52:37-51.
20. Maenhout TM, De Buyzere ML, Delanghe JR. Non-oxidative ethanol metabolites as a measure
of alcohol intake. Clinica Chimica Acta. 2013;415:322-9.
21. Helander A, Beck O. Ethyl Sulfate: A Metabolite of Ethanol in Humans and a Potential
Biomarker of Acute Alcohol Intake. Journal of Analytical Toxicology. 2005;29(5):270-4.
22. Stewart SH, Koch DG, Burgess DM, Willner IR, Reuben A. Sensitivity and specificity of urinary
ethyl glucuronide and ethyl sulfate in liver disease patients. Alcohol Clin Exp Res. 2013;37(1):150-5.
23. Reinert DF, Allen JP. The alcohol use disorders identification test: an update of research
findings. Alcohol Clin Exp Res. 2007;31(2):185-99.
24. Winkler M, Skopp G, Alt A, Miltner E, Jochum T, Daenhardt C, et al. Comparison of direct and
indirect alcohol markers with PEth in blood and urine in alcohol dependent inpatients during
detoxication. International Journal of Legal Medicine. 2012;127(4):761-8.
25. Boscolo-Berto R, Viel G, Montisci M, Terranova C, Favretto D, Ferrara SD. Ethyl glucuronide
concentration in hair for detecting heavy drinking and/or abstinence: a meta-analysis. Int J Legal
Med. 2013;127(3):611-9.
26. Niemelä O. Biomarker-Based Approaches for Assessing Alcohol Use Disorders. International
Journal of Environmental Research and Public Health. 2016;13(2):166.
27. Wurst FM, Alling C, Aradottir S, Pragst F, Allen JP, Weinmann W, et al. Emerging biomarkers:
new directions and clinical applications. Alcohol Clin Exp Res. 2005;29(3):465-73.
28. Niemela O. Biomarkers in alcoholism. Clin Chim Acta. 2007;377(1-2):39-49.
29. Bianchi V, Ivaldi A, Raspagni A, Arfini C, Vidali M. Use of carbohydrate-deficient transferrin
(CDT) and a combination of GGT and CDT (GGT-CDT) to assess heavy alcohol consumption in traffic
medicine. Alcohol Alcohol. 2010;45(3):247-51.
30. Hannuksela ML, Liisanantti MK, Nissinen AE, Savolainen MJ. Biochemical markers of
alcoholism. Clin Chem Lab Med. 2007;45(8):953-61.
31. Musshoff F, Albermann E, Madea B. Ethyl glucuronide and ethyl sulfate in urine after
consumption of various beverages and foods--misleading results? Int J Legal Med. 2010;124(6):623-
30.
32. Thierauf A, Halter CC, Rana S, Auwaerter V, Wohlfarth A, Wurst FM, et al. Urine tested
positive for ethyl glucuronide after trace amounts of ethanol. Addiction. 2009;104(12):2007-12.
33. Shi X, Yao D, Chen C. Identification of N-acetyltaurine as a novel metabolite of ethanol
through metabolomics-guided biochemical analysis. J Biol Chem. 2012;287(9):6336-49.
50
34. Høiseth G, Bernard JP, Karinen R, Johnsen L, Helander A, Christophersen AS, et al. A
pharmacokinetic study of ethyl glucuronide in blood and urine: Applications to forensic toxicology.
Forensic Science International. 2007;172(2–3):119-24.
35. Allen JP, Wurst FM, Thon N, Litten RZ. Assessing the drinking status of liver transplant
patients with alcoholic liver disease. Liver Transpl. 2013;19(4):369-76.
36. Kharbouche H, Faouzi M, Sanchez N, Daeppen JB, Augsburger M, Mangin P, et al. Diagnostic
performance of ethyl glucuronide in hair for the investigation of alcohol drinking behavior: a
comparison with traditional biomarkers. Int J Legal Med. 2012;126(2):243-50.
37. Stewart SH, Koch DG, Willner IR, Randall PK, Reuben A. Hair ethyl glucuronide is highly
sensitive and specific for detecting moderate-to-heavy drinking in patients with liver disease. Alcohol
Alcohol. 2013;48(1):83-7.
38. Arndt T, Gruner J, Schrofel S, Stemmerich K. False-positive ethyl glucuronide immunoassay
screening caused by a propyl alcohol-based hand sanitizer. Forensic Sci Int. 2012;223(1-3):359-63.
39. Helander A, Olsson I, Dahl H. Postcollection synthesis of ethyl glucuronide by bacteria in urine
may cause false identification of alcohol consumption. Clin Chem. 2007;53(10):1855-7.
40. Baranowski S, Serr A, Thierauf A, Weinmann W, Grosse Perdekamp M, Wurst FM, et al. In
vitro study of bacterial degradation of ethyl glucuronide and ethyl sulphate. Int J Legal Med.
2008;122(5):389-93.
41. Isaksson A, Walther L, Hansson T, Andersson A, Alling C. Phosphatidylethanol in blood (BPEth):
a marker for alcohol use and abuse. Drug Test Anal. 2011;3(4):195-200.
42. Viel G, Boscolo-Berto R, Cecchetto G, Fais P, Nalesso A, Ferrara SD. Phosphatidylethanol in
blood as a marker of chronic alcohol use: a systematic review and meta-analysis. Int J Mol Sci.
2012;13(11):14788-812.
43. Hartmann S, Aradottir S, Graf M, Wiesbeck G, Lesch O, Ramskogler K, et al.
Phosphatidylethanol as a sensitive and specific biomarker: comparison with gamma-glutamyl
transpeptidase, mean corpuscular volume and carbohydrate-deficient transferrin. Addict Biol.
2007;12(1):81-4.
44. Walther L, de Bejczy A, Löf E, Hansson T, Andersson A, Guterstam J, et al.
Phosphatidylethanol is Superior to Carbohydrate-Deficient Transferrin and γ-Glutamyltransferase as
an Alcohol Marker and is a Reliable Estimate of Alcohol Consumption Level. Alcoholism: Clinical and
Experimental Research. 2015;39(11):2200-8.
45. Johnson RD, Lewis RJ, Canfield DV, Dubowski KM, Blank CL. Utilizing the urinary 5-HTOL/5-
HIAA ratio to determine ethanol origin in civil aviation accident victims. J Forensic Sci.
2005;50(3):670-5.
46. Kalapatapu RK, Chambers R. Novel Objective Biomarkers of Alcohol Use: Potential Diagnostic
and Treatment Management Tools in Dual Diagnosis Care. Journal of dual diagnosis. 2009;5(1):57-82.
47. Auwarter V, Sporkert F, Hartwig S, Pragst F, Vater H, Diefenbacher A. Fatty acid ethyl esters in
hair as markers of alcohol consumption. Segmental hair analysis of alcoholics, social drinkers, and
teetotalers. Clin Chem. 2001;47(12):2114-23.
51
48. Luginbühl M, Schröck A, König S, Schürch S, Weinmann W. Determination of fatty acid ethyl
esters in dried blood spots by LC–MS/MS as markers for ethanol intake: application in a drinking
study. Analytical and Bioanalytical Chemistry. 2016:1-7.
49. Jokiel MS, G. N-Acetyltaurine - preliminary work to prove its potential as a marker of alcohol
consumtion. Toxichem Krimtech. 2015(82).
50. Lambert IH, Kristensen DM, Holm JB, Mortensen OH. Physiological role of taurine – from
organism to organelle. Acta Physiologica. 2015;213(1):191-212.
51. Lourenco R, Camilo ME. Taurine: a conditionally essential amino acid in humans? An
overview in health and disease. Nutr Hosp. 2002;17(6):262-70.
52. Miyazaki T, Ishikura K, Honda A, Ra S-G, Komine S, Miyamoto Y, et al. Increased NAcetyltaurine
in Serum and Urine After Endurance Exercise in Human. In: Marcinkiewicz J, Schaffer
WS, editors. Taurine 9. Cham: Springer International Publishing; 2015. p. 53-62.
53. Betancourt J, Gottlieb S. Liquid chromatography [Available from:
http://chemwiki.ucdavis.edu/Core/Analytical_Chemistry/Instrumental_Anal…
uid_Chromatography.
54. How does High Performance Liquid Chromatography work? [Available from:
http://www.waters.com/waters/en_BE/How-Does-High-Performance-Liquid-Chr…-
Work%3F/nav.htm?cid=10049055&locale=en_BE.
55. Cohen Freue GV, Borchers CH. Multiple reaction monitoring (MRM): principles and
application to coronary artery disease. Circ Cardiovasc Genet. 2012;5(3):378.
56. Korfmacher WA. Foundation review: Principles and applications of LC-MS in new drug
discovery. Drug Discovery Today. 2005;10(20):1357-67.
57. Picotti P, Aebersold R. Selected reaction monitoring-based proteomics: workflows, potential,
pitfalls and future directions. Nat Methods. 2012;9(6):555-66.
58. Naegele E. Making your LC Method Compatible with Mass Spectrometry. 2011.
59. Biosystems A. LC/MS/MS Solutions for Forensic Drug Screening. USA: 2005.
60. 李加贺 庄, 毕华, inventorMethod for preparing high-purity acetyl homotaurine. China2014.
61. Administration FaD. Guidance for Industry: Bioanalytical Method Validation. In: Services HaH,
editor. U.S.2001.
62. Agency EM. Guideline on bioanalytical method validation. London2011.
63. Matuszewski BK, M. L. Constanzer, and C. M. Chavez-Eng. "Strategies for the assessment of
matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS.". Analytical chemistry
2003;75(13):3019-30.
64. Widmark EMP. Principles and applications of medicolegal alcohol determination: Biomedical
Publications; 1981.
52
65. Schroeck A, et al. "Progress in monitoring alcohol consumption and alcohol abuse by
phosphatidylethanol. Bioanalysis. 2014;6(17):2285-94.
66. DiFiori JP, Benjamin HJ, Brenner JS, Gregory A, Jayanthi N, Landry GL, et al. Overuse injuries
and burnout in youth sports: a position statement from the American Medical Society for Sports
Medicine. British journal of sports medicine. 2014;48(4):287-8.








